繼今年10月與羅氏達成合作后,應世生物創(chuàng)新抗癌藥IN10018片又迎來新進展�����。中國國家藥監(jiān)局藥品審評中心(CDE)網(wǎng)站最新數(shù)據(jù)顯示�����,IN10018片已在中國獲得臨床試驗默示許可��,適應癥為局部晚期或轉移性胃或胃食管交界處腺癌���,這是應世生物成立以來在中國獲得的首個臨床批件。IN10018片是應世生物從勃林格殷格翰(BI)引進的一款黏著斑激酶(FAK)抑制劑��,今年8月該藥剛在美國獲得臨床試驗許可(IND)。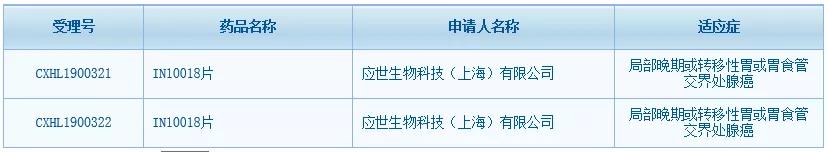
IN10018是勃林格殷格翰開發(fā)的一款FAK抑制劑��,應世生物現(xiàn)在擁有該藥的全球開發(fā)和商業(yè)化權利����。FAK在許多對腫瘤發(fā)展至關重要的細胞功能如粘附、遷移���、增殖和免疫逃逸中都起作用�,F(xiàn)AK抑制劑可通過癌細胞或免疫介導作用來抑制腫瘤生長和轉移��。臨床前研究表明���,IN10018能顯著提高化療�、放療���、靶向藥物����、以及免疫治療的療效���,形成協(xié)同效應���,克服耐藥,有望成為諸多治療藥物的最佳聯(lián)合治療藥物��。2019年8月30日���,IN10018在美國獲得臨床試驗許可(IND)�����,這是應世生物首個獲得FDA臨床試驗許可的創(chuàng)新藥�。10月12日�,應世生物宣布與羅氏制藥達成一項全球范圍內(nèi)的臨床試驗合作,對IN10018與羅氏旗下的小分子MEK抑制劑cobimetinib展開聯(lián)合用藥臨床研究����,以評估聯(lián)合療法在葡萄膜黑色素瘤癌癥患者中的安全性、耐受性�����、以及抗腫瘤療效��。根據(jù)應世生物官網(wǎng)公開信息,IN10018是應世生物產(chǎn)品管線中進展最快的藥物�。該藥正在與靶向藥物、化療�、免疫療法、放療開展聯(lián)合研究����,在黑色素瘤、卵巢癌��、胃癌����、胰腺癌和非小細胞肺癌中的研究已進入1期臨床階段。

應世生物由王在琪博士于2018年12月創(chuàng)立���,王在琪博士曾在羅氏�����、默沙東���、禮來等公司任職,擁有20年豐富的臨床開發(fā)經(jīng)驗����,并負責過Keytruda與Gardasil的中國臨床試驗與注冊上市����。

以疾病生物學為創(chuàng)新源頭�����,應世生物致力于打造“最佳聯(lián)合用藥研發(fā)策略”�,建立具備快速臨床轉化與概念驗證能力的平臺�����,成為一家在新藥研發(fā)2.0時代立足于中國服務全球新藥研發(fā)公司��。目前該公司已經(jīng)完成數(shù)千萬美元的A輪融資�����。除了IN10018外�����,該公司的產(chǎn)品線還包括一款針對肝癌和結直腸癌的候選藥物IN10126���,目前正處于IND準備階段�����,以及一款正處于探索階段的候選藥物IN30101�。我們祝賀應世生物FAK抑制劑IN10018片在中國獲得臨床試驗默示許可,希望該藥的臨床試驗并順利開展并取得好的結果��,為患者帶來更多的治療選擇��。





